
教授长期致力于发展高效、高选择性不对称催化反应,利用自己原创的手性配体工具箱为技术平台,以重大药物合成为产业化突破口,开发有自主知识产权、安全、环保、低成本、高质量的药物绿色合成新工艺。近年来也致力于拓展小分子化合物库并开展高通量生物筛选、分析药效团构效关系,研发新型小分子药物。2020年初新冠疫情爆发以后,教授携团队与中山大学郭德银教授团队开发抗新冠口服药物,化合物“SHEN26”是科技部新冠专项资助的五个小分子抗新冠药物中的一个,疗效显著优于Molnupiravir。
教授在不对称氢化和手性膦配体研究领域已经有二十多年的研究经历,并且取得了丰硕的研究成果。教授是全球磷化学领域的权威专家,曾经连续两次受邀在第16届和17届国际磷化学会议上做大会报告(2004年在英国伯明翰;2007年在中国厦门)。教授开发的手性工具箱广泛应用于不对称氢化、不对称氢甲酰化反应等领域,在不对称催化领域具有广泛的国际影响力,其中DuanPhos、Binapine、TangPhos、TunePhos等配体在国际上应用较为广泛。
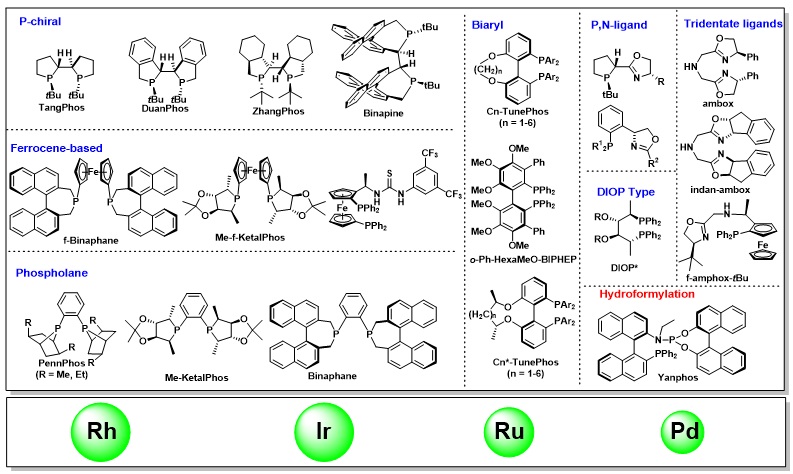

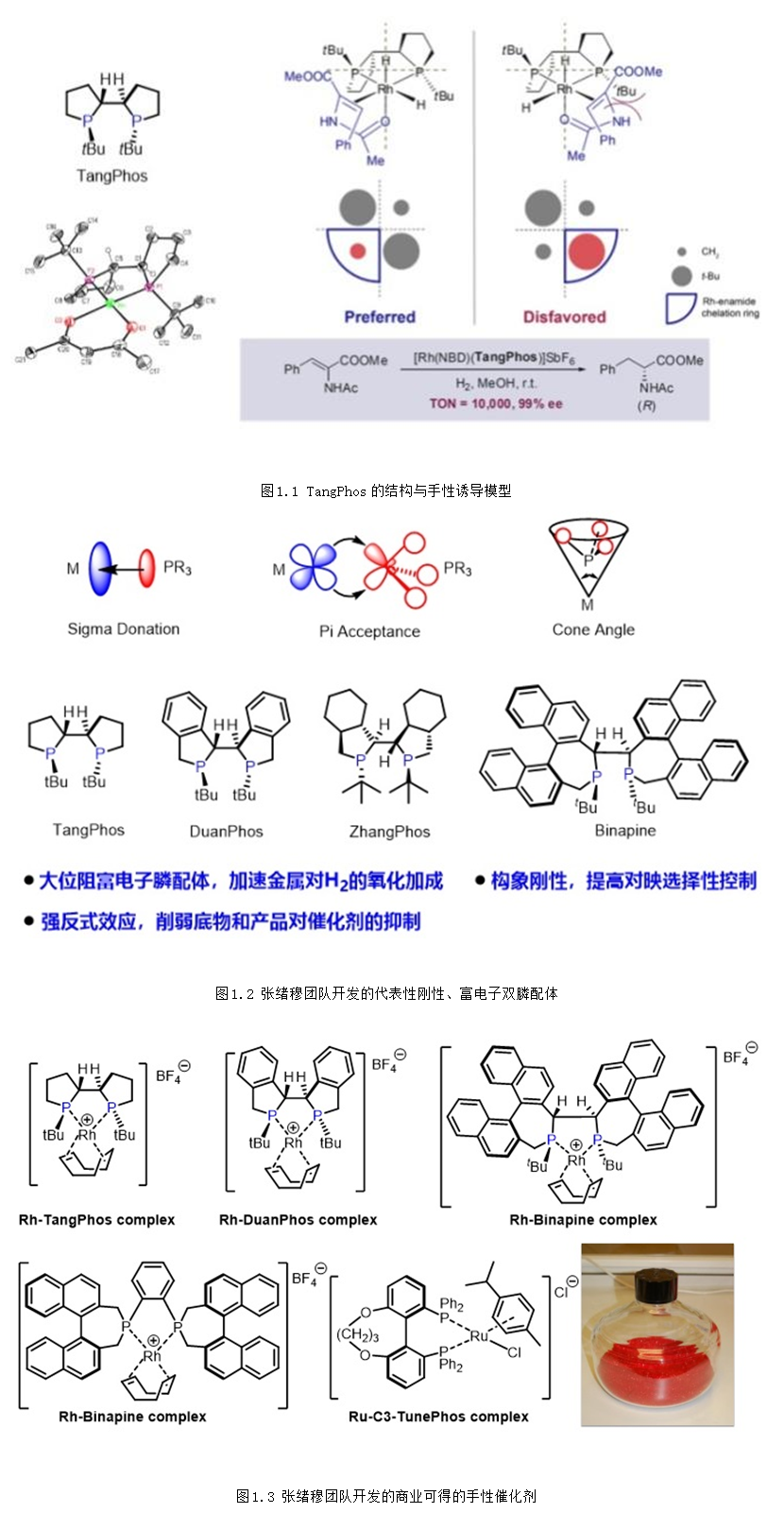
教授在手性配体的合成和应用方面做出了许多开创性的工作,发展了系列刚性、富电子的三烷基双膦配体,如TangPhos、DuanPhos、Binapine等应用于铑金属的不对称氢化。该类富电子膦配体能够加速一价Rh对氢气的氧化加成,提高反应性(图1.2)。同时,强的反位效应可以减少产物抑制,提高转化数。由于配体的刚性,能给出很好的立体选择性。以上几种特性,使得该类配体成为铑金属不对称氢化中的超实用配体,广泛应用于凯瑞斯德生化(苏州)有限公司工业化生产,其中多个配体的金属络合物已经成为商业可得的高效金属催化剂,可以从试剂公司Strem或Aldrich购买得到(图1.3)(Acc. Chem. Res. 2020, 53, 1905–1921; Acc. Chem. Res. 2007, 40, 1278-1290; Chem. Rev. 2003, 103, 3029-3069; Chin. J. Chem. 2020, 38, 954-968)。

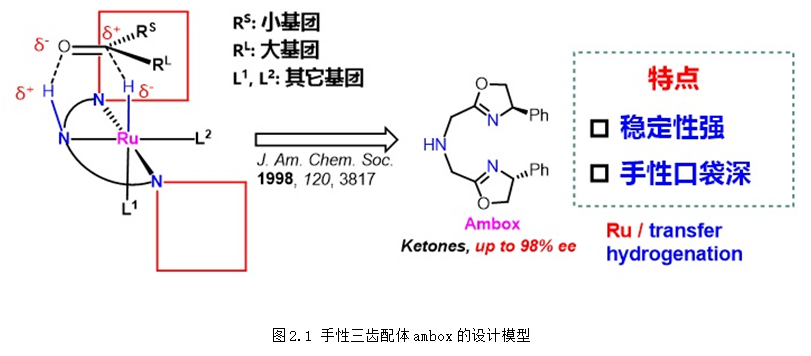
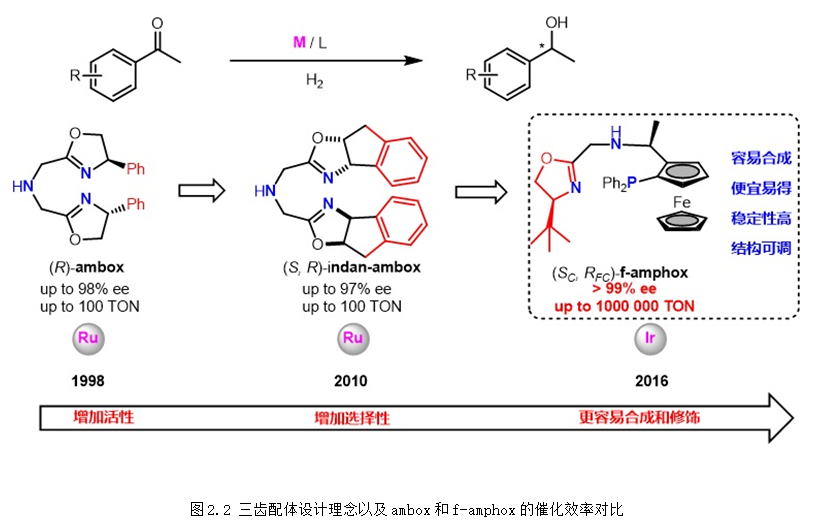
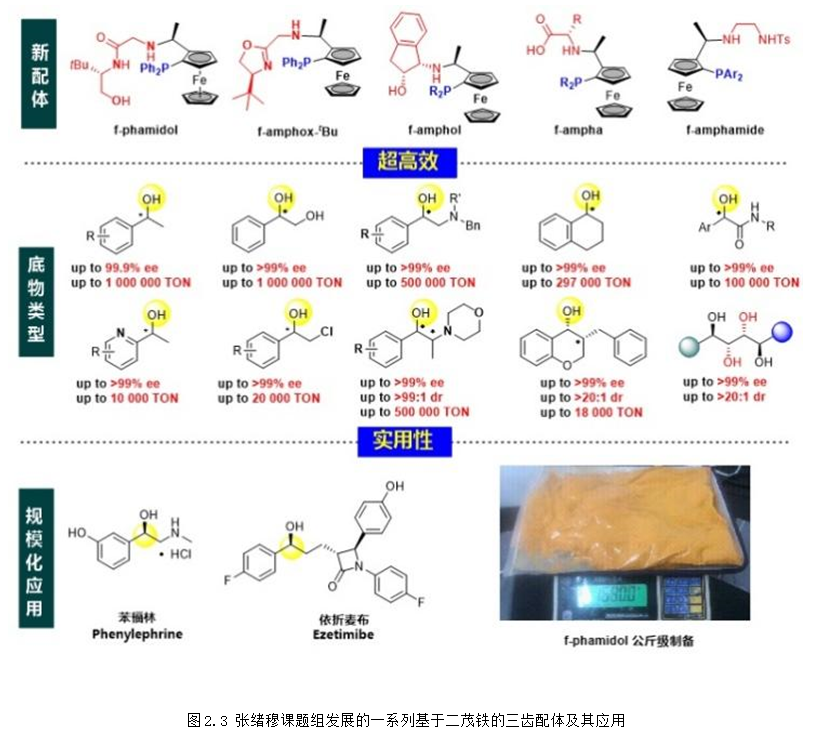
上个世纪90年代,教授在国际上率先将手性三齿配体应用于简单酮不对称(转移)氢化。1998年,首次发展的三齿配体ambox在不对称转移氢化、不对称转移氢化中表现出优异的对映选择性控制。从2016年开始,以廉价的Ugi胺为手性原料,陆续发展了f-amphox、f-amphol、f-ampha、f-amphamide等一系列容易合成、结构可调的二茂铁骨架手性三齿配体,在羰基化合物的不对称氢化中表现超高的催化效率 (TON:1,000,000) 和对映选择性 (>99% ee),含膦大位阻二茂铁骨架的引入不仅提高了配体的活性和选择性,也使得配体更加稳定和更加容易修饰。
和Noyori的催化体系相比,团队发展的三齿配体具有以下特点:(1) 形成的铱催化剂异常稳定;(2) 具有超高的反应活性;(3) 配位饱和有效地阻止了产物的抑制作用。此外,三齿配体对碱的容忍性更好,具有更高的催化效率,更广的底物适用范围。

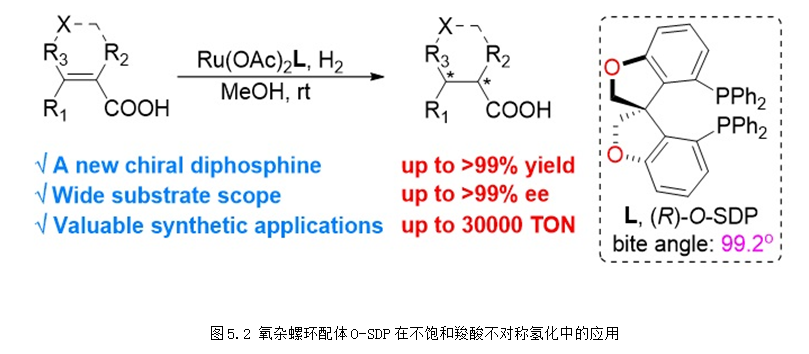
过渡金属催化的不对称反应的发展高度依赖于手性配体的发展,为了进一步提高不对称催化反应的对映选择性和反应活性,发展更为高效、更为实用同时易于合成和对空气稳定的手性膦配体具有重要意义。非共价键相互作用在催化剂的设计中扮演着重要的角色,能够稳定反应的过渡态,减少过渡态中的自由度,降低反应的活化能。代表性的非共价键相互作用有空间排斥作用、氢键和离子对相互作用,其中氢键和离子对相互作用较强。基于“非共价键相互作用”策略,研究团队将氢键和离子对相互作用引入到手性双膦配体中,发展新型高效的手性双膦配体,2020年,团队在Acc. Chem. Res.上对该部分工作进行详细的介绍 (Acc. Chem. Res. 2020, 53, 1905-1921)。


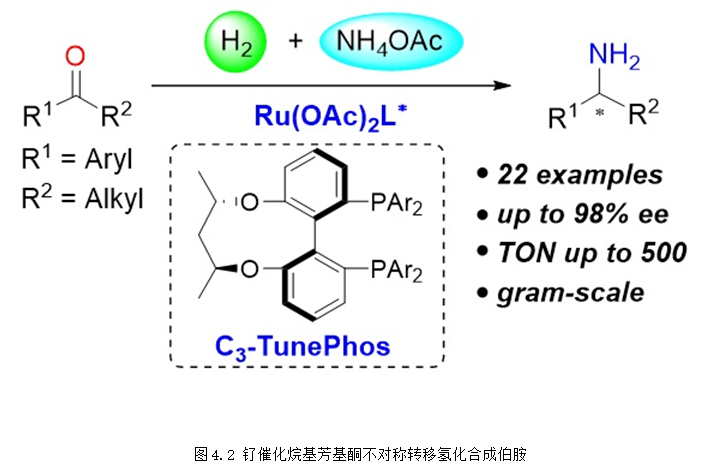
2018年,课题组利用无机氨盐为胺源,钌的C3*-TunePhos络合物为催化剂,氢气为还原剂,实现了简单芳基酮的不对称还原胺化,通过该方法可以高效合成得到手性伯胺产物(图4.2)。该反应具有非常重要的应用价值,目前已被成功应用于重大药物西那卡塞关键中间体的不对称合成当中 (J. Am. Chem. Soc. 2018, 140, 2024-2027),该研究工作被Synfacts杂志选为亮点进行评述 (Synfacts 2018, 14, 0504)。
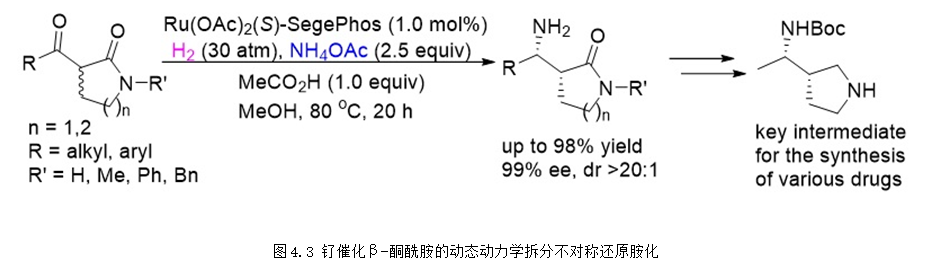
同年,课题组也实现了环状β-酮酰胺的动态动力学拆分不对称还原胺化,能够以高达98%的收率99%的ee值合成得到手性伯胺产物,该产物经过简单的转化就可以合成得到许多药物的关键中间体 (图4.3),具有非常好的实用价值 (Angew. Chem. Int. Ed., 2018, 57, 14193-14197)。


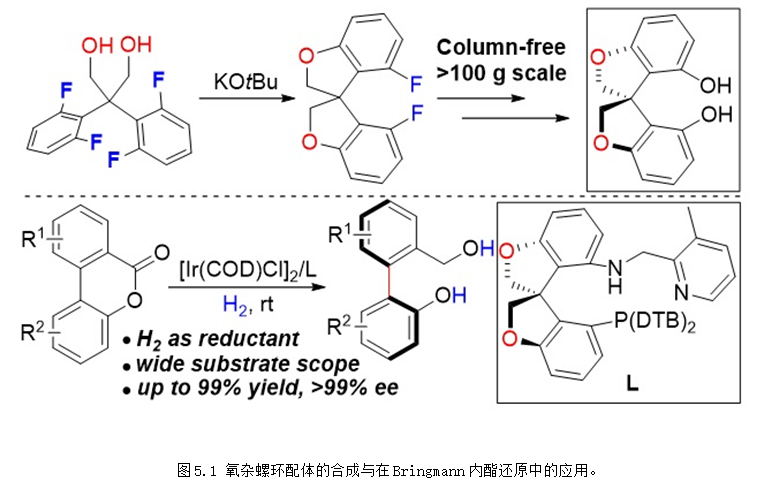
但是螺环配体也存在骨架结构单一等缺点。为了克服上述难题,2018年,课题组以分子内的双重芳香亲核取代为关键步骤高效合成得到了一种新型氧杂螺环二酚骨架O-SPINOL,并以O-SPINOL为起始原料合成得到了O-SpiroPAP配体,该配体在Bringmann内酯的动态动力学拆分不对称还原中表现出优异的反应活性和对映选择性 (图5.1) (J. Am. Chem. Soc. 2018, 140, 8064-8068),该研究工作被Synfacts杂志选为亮点进行评述 (Synfacts 2018, 14, 1050)。

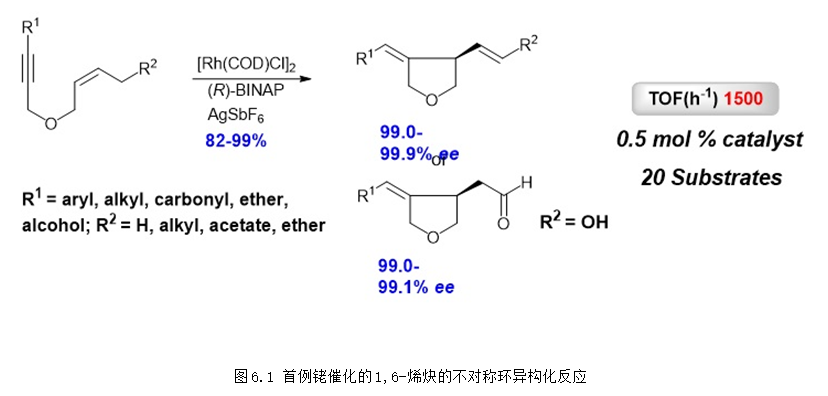
过渡金属催化的烯炔环异构化反应是构建环状化合物非常高效的方法,早在2000年,课题组研究发现1,6-烯炔底物在铑-双膦配体催化剂的作用下可以以非常高的区域选择性得到五元杂环或者碳环化合物,该反应是首例铑催化的1,6-烯炔环异构化反应 (Angew. Chem. Int. Ed. 2000, 39, 4104-4106)。后续的研究发现采用BINAP作为手性配体就可以得到非常高的对映选择性,并且该反应具有非常广泛的底物适用范围,2016年,团队成功将该反应的底物适用范围由顺式双键底物扩展到了更常见的反式双键底物。
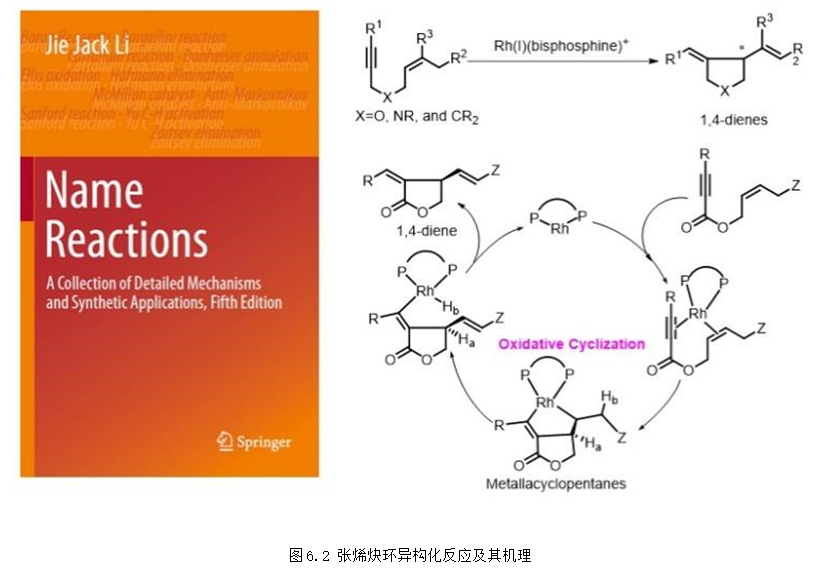
2014年3月,教授的研究成果“烯炔的环异构化反应”,被冠以“张”姓,命名为“Zhang enyne cycloisomerization”。该成果已被国际化学权威著作Name Reactions 收录,成为以中国人名命名的为数不多的人名反应之一(图6.2)。
"张烯炔环异构化反应"有着广泛的适用性和实用性,利用该反应可以方便的实现烯烃和炔烃分子内的不对称环化,高效地构筑了一系列五元杂环化合物,在生物活性分子以及药物分子的合成中有重要的应用。例如,世界著名的有机化学家Nicolaou教授用教授发展的人名反应实现了复杂活性分子平板霉素的全合成 (J. Am. Chem. Soc. 2009, 131, 16905-16918)。团队也采用该合成方法实现了Kainic acid的高效不对称合成 (Chem. Commun. 2018, 54, 727-730)。
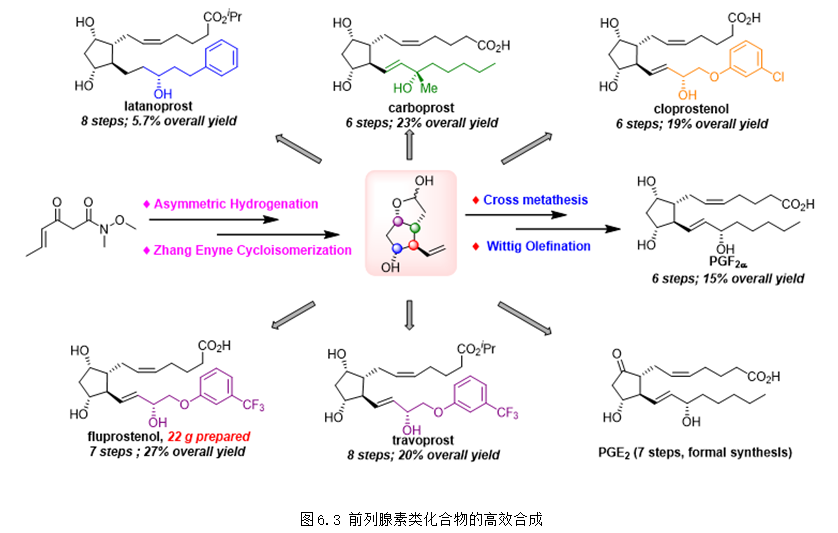
2021年,团队在烯炔环异构化领域再次取得重要进展,以三齿配体铱络合物催化的烯酮不对称氢化和课题组发展的“烯炔环异构化”反应为关键步骤实现了系列前列腺素和相关药物的简洁、高效不对称全合成,将合成步骤缩短到了6步,极大地提高了合成效率,并且实现了20克规模合成氟前列醇 (fluprostenol),相关研究成果发表在Nat. Chem.上 (Nat. Chem. 2021, 13, 692-697)。前列腺素是一类具有广泛生物活性的激素类物质,具有非常好的成药性,目前,在世界范围内有超过20种前列腺素类上市药物。该研究成果极大地提高了前列腺素类化合物的合成效率,对前列腺素相关药物的研究具有重要意义(图6.3)。


氢甲酰化反应是以烯烃和合成气为原料高效合成醛类化合物的重要反应。由于醛类化合物在工业合成中有着极其重要的应用,氢甲酰化反应被学术界和工业界广泛研究,并已发展成为当今工业上规模最大的均相催化反应之一。据统计,全球通过氢甲酰化生产醛、醇的能力已经达到千万吨规模。相比较而言,利用手性催化剂合成手性醛的不对称氢甲酰化反应的发展却比较缓慢,目前还没有工业应用的报道。手性配体对于不对称氢甲酰化反应的活性、化学选择性和对映选择性都有显著影响,目前能够应用于不对称氢甲酰化反应的手性配体的种类非常有限,新型手性配体的开发是该领域最具挑战性的难题,在该领域中有将近一半的手性配体都是研究团队开发的(图7.1)。
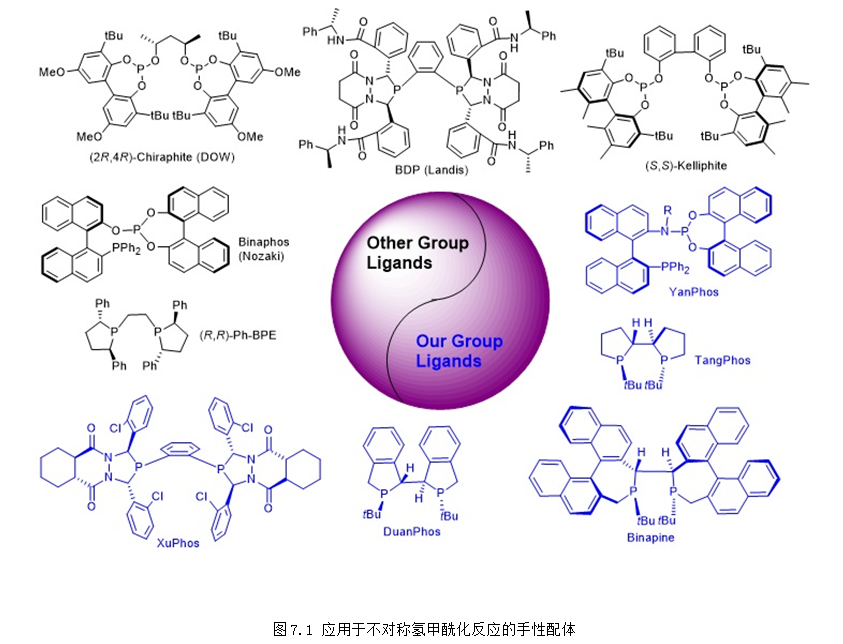
教授开发的YanPhos是在不对称氢甲酰化反应中应用最为广泛的手性配体之一,在多种底物类型的不对称氢甲酰化反应中表现出优异的反应活性和对映选择性:(1) YanPhos在4-取代环戊烯类底物的去对称化不对称氢甲酰化反应中表现出优异的反应活性和対映选择性 (up to 96% yield, up to >99:1 dr, up to 97% ee; Angew. Chem. Int. Ed., 2016, 55, 6511-6514)。(2) YanPhos在1,2-二取代硅基烯烃的不对称氢甲酰化反应中表现出优异的区域选择性和对映选择性 (up to 98% yield, up to >99:1 dr and up to 97% ee; Nat. Commun. 2018, 9, 2045)。(3) YanPhos在挑战性底物1,1-二取代烯烃的不对称氢甲酰化反应中表现出优异的区域选择性和对映选择性 (J. Am. Chem. Soc, 2018, 140, 4977-4981)。


 沪ICP备17019645号
沪ICP备17019645号



 400-821-0725
400-821-0725





